
《生物技术》

在上注册的间充基质细胞 [MSC] 相关临床试验已经超过了1050项,完成300多项,其安全性已得到广泛验证,也有近10个产品获批上市。
不过,中国、美国和欧盟对MSC产品的监管更严格,中美都还未批准产品上市,欧盟仅有一个Alofisel。

细胞产品临床转化难,主要因为它们是一种活的药物。难以界定MSC产品的关键质量属性(CQA),临床上也就不好预测其治疗作用。
早期,国际细胞与基因治疗学会 [ISCT] 给出的MSC最低表型标准只反映了干细胞的「干性」,即自我更新和多向分化的能力。
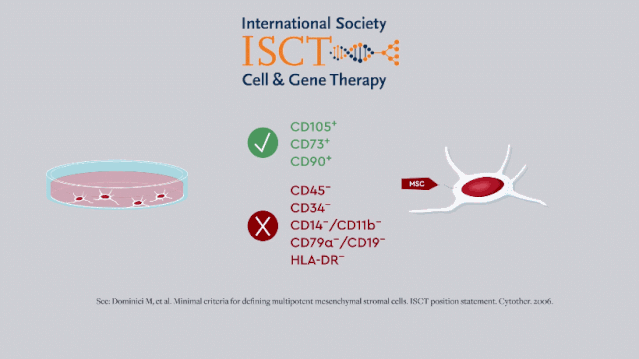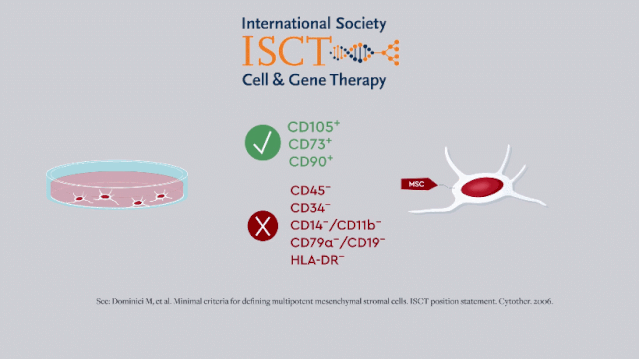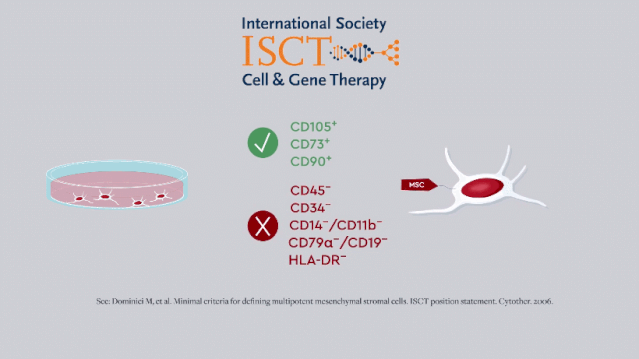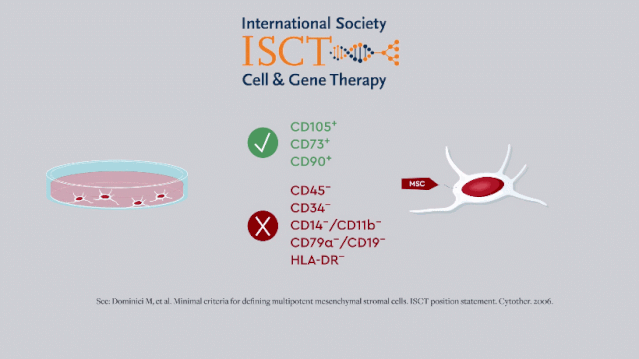
随着研究的开展,免疫调节和营养作用逐渐被发现是其主要治疗特性,MSC也被广泛用于神经退行性病变和炎性疾病的治疗。
2019年,ISCT更新了MSC的定义标准和CQA,这也要求研发人员改进MSC效力的体外测定方法。

然而,维持稳定的CQA并非易事,影响疗效的因素也不限于MSC产品自身。
近期ScienceAdvances发表的一篇文章指出,MSC产品的异质性、给药方式和患者反应差异,是影响MSC临床试验达到主要疗效终点的三个主要障碍。
而要改善「原生态MSC」的表现,生物工程技术或许是一个答案。
MSC临床应用挑战:产品异质性FDA将细胞产品的效力定义为:可在适当方法实验室检测下,或在可控条件下通过大量临床数据获得的产品特殊能力或功能。
在开始临床试验之前,MSC产品效力的标准化是至关重要的。
然而,不同的细胞来源、供体、制备方式都可能会造成MSC产品的批间差异,也就是异质性。
供者差异可能造成的异质性

细胞来源造成的异质性 来源@YT
作者举了一个例子,来说明MSC制备的差别对临床试验的影响。
Remestemcel-L 一项治疗GvHD的3期临床试验使用了来自1个供体扩增至3-4代的MSC,以满足240名受试者的使用需求。虽然结果还比较积极,但没能达到主要临床终点。
同样是针对GvHD患者,另一项法兰克福大学医院开展的2期临床试验使用了来自8个供体的1-2代MSC,治疗26名患者,却取得了77%的总缓解率。
3期临床试验招募的受试者数量更多,对MSC质量和数量要求更高。如果产品异质性控制不佳,将会拖累临床试验结果。

该文未讨论的一个措施:干细胞自动化生产可减少人为操作因素,也能降低异质性风险@YT
而在制备过程中避免MSC产品异质性的策略目前有:
生物材料
在无酒精聚乙二醇水凝胶基质上扩增MSC能避免细胞表面标志物和细胞因子表达的降低。3D培养系统也有利于MSC在扩增过程中维持早期传代的表型。
诱导多能干细胞
由于iPSC与MSC相比具有更强的增殖能力,因此可以轻松扩增以生成大量iPSC,然后再分化获得数量可观的低传代MSC。因此,iPSC-MSC可能是规模化生产MSC的有效解决方案。
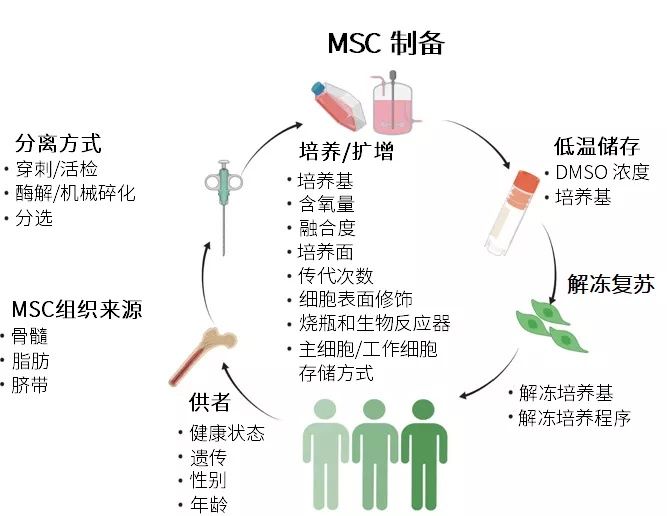
产品异质性的另一大挑战,是冷冻保存对MSC效力的潜在不利影响。一些研究者发现,可以通过改变使用前处理MSC的方式来解决。
例如,Alofisel治疗肛周瘘管3期临床试验的成功,可能就归功于对解冻后的MSC采用了「培养复苏」,这一过程涉及在细胞培养条件下复苏新鲜解冻的MSC,解冻到输注需要至少24小时。
这一成功表明,冷冻对细胞的不利影响是可逆的。
生物工程解决方案:增强效力面对这些挑战,作者建议探索替代生物工程策略,通过大幅提高细胞效力,促进MSC的临床转化。

小分子预处理MSC是一种增强其治疗作用的简易策略。
NurOwn是应用该策略的MSC产品中的代表,其专利培养基可诱导细胞分泌高水平神经营养因子,将MSC转化为MSC-NTF细胞。后者可以有效地将多种神经营养因子和免疫调节细胞因子直接递送至损伤部位,触发所需的生物学效应,并最终减缓或稳定疾病的进展。
在一项2期临床试验(NCT0)中,肌萎缩侧索硬化症患者在接受NurOwn治疗24个月后,病情进展与对照组相比减缓。
上一篇:2020年9月24日山东康震生物技术有限公司以底价竞
下一篇:没有了